|
효소 |
화학반응은 한 물질이 다른 물질로 바뀌는 과정입니다. 화학반응이 일어나기 전의 물질을 '반응물', 반응이 일어나 생긴 물질을 '생성물'이라고 하지요.

그런데 여러 화학반응들은 우리가 살아가는 온도(섭씨 20도 전후)에서 진행되는 속도가 다 달라서, 천천히 일어나는 반응도 있고 빨리 일어나는 반응도 있습니다. 그리고 모든 화학반응은 온도가 높아질수록 빨리 일어납니다. 음식이 부패하는 것도 화학반응인데, 더운 여름엔 음식이 더 빨리 상하고, 시원한 냉장고 속에선 천천히 상하는 것은도 이 이유 때문이지요.


우리가 살아 있을 수 있는 것은 우리 몸에서 쉴 새 없이 일어나는 화학반응 때문입니다. 우리 몸에서 일어나는 화학반응을 대사라고 부르지요. 예를 들어 음식물을 소화시키고, 소화된 음식물을 태워 열과 에너지를 얻는 과정이 바로 우리 몸 안에서 일어나는 화학반응입니다.
그런데 우리 몸 안에서 일어나는 대부분의 반응들은 우리의 체온(섭씨 36도 근처)에서는 아주 천천히 일어납나는 것이 대부분입다. 그렇게 천천히 반응이 일어나면 우리의 생명을 유지할 수 없지요. 그렇다고 반응이 빨라지라고 우리의 체온을 100℃로 마구 올릴 수도 없구요. 그렇다면 어떻게 우리가 살아갈 수 있는 걸까요?
바로 촉매 덕분입니다. 특히 우리 몸 안에서 대사의 속도를 빠르게 해주는 촉매를 효소라고 부릅니다.
소화 효소라는 말을 많이 들어 봤지요? 효소는 그것이 없다면 1년이 걸릴 수도 있는 반응을 몇 초 사이에 해치울 수도 있다고 합니다.
사람의 몸에는 약 2000 종류의 효소들이 있다고 합니다. 각 종류의 효소는 각기 다른 반응을 빠르게 하지요. 그런데 어떻게 각 효소는 자기가 촉매해야 하는 반응을 아느냐구요? 그 이유는 효소가 단백질이기 땨문입니다.
단백질은 아미노산이라는 작은 분자들이 수없이 많이 이어진 것이지요. 그런데 단백질은 아미노산 분자들이 일렬로 선 일자 모양을 하고 있는 것이 아니고 일정한 모양으로 접혀 있습니다. 일정한 모양을 가지고 있다는 것이 아주 중요합니다. 열쇠와 자물쇠에 비유해 보면 한 자물쇠를 열 수 있는 것은 특별한 모양을 한 한가지 열쇠 밖에는 없지요.
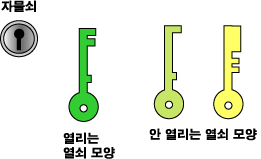
같은 원리가 효소와 효소가 촉매 하는 반응의 반응물에도 적용됩니다. 효소의 모양과 반응물의 모양은 그림 맞추기의 두 조각처럼 딱 맞습니다. 그래서 효소는 촉매해야 할 반응의 반응물을 가려내고, 따라서 특정 반응을 촉매 하게 되는 거지요.


우리 몸 속에서 일어나는 대사는 여러 반응이 연결되어 순서대로 진행되는 경우가 대부분입니다. 한 효소가 반응물을 생성물로 바꾼 후 그 다음 효소에게 넘겨주면 그것을 또 다른 생성물로 바꾸어 주지요.
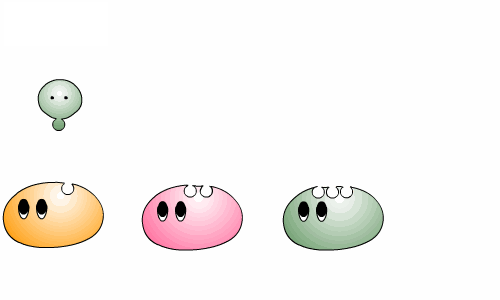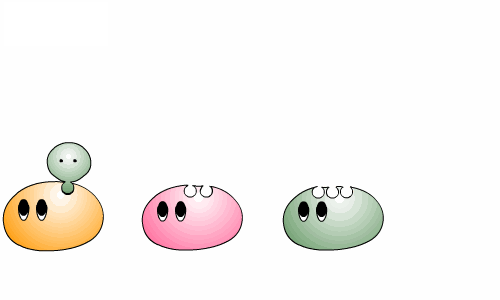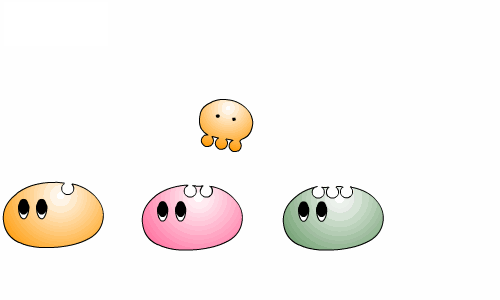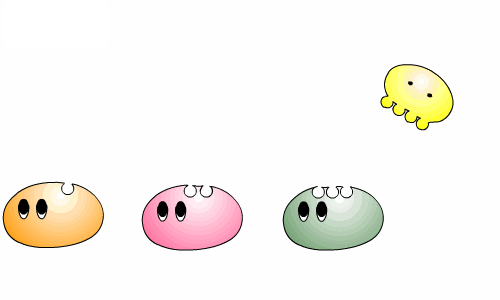
우리 몸이 정상적으로 작동하려면 여러 효소들 사이의 조화로운 협동이 필수적입니다. 효소를 만드는 단백질은 몸에 저장되지 않기 때문에 매일 적정량의 단백질을 먹어야 합니다. 그렇지 않은 경우 일부 효소가 부족하게 되고, 이 경우 그 효소가 촉매 하는 반응 뿐 아니라 연결된 다른 반응들도 영향을 받게 되므로, 효소의 부족은 우리의 건강을 크게 해칩니다.