|
|
준비물 |
|
실험과 관찰 |
1.
모든 재료를 병에 넣고 잘 흔들어 섞는다.
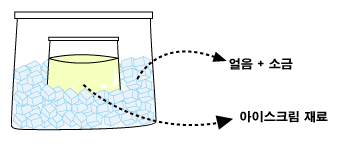
2. 작은 지퍼백 세 개에 흔들어 섞은 재료를 나누어 넣고 닫는다. 3. 큰 지퍼백 두 개를 준비해서 첫 번째 지퍼백에는 얼음과 얼음의1/3정도양의 소금, 두 번째 지퍼백에는 얼음과 얼음 1/3정도의 설탕, 세 번째 지퍼백에는 얼음만 넣는다. 4. 작은 지퍼백을 큰 지퍼백에 넣고 각각 관찰한다.
※ 간단한 방법을 원하면 아래 그림과 같이 하세요.
|
   |
  |
   |
   |
|
왜 그럴까요? |
얼음에 소금이나 설탕을 뿌리면 얼음이 녹기 시작합니다. 그것은 어떤 의미일까요? 물질의 녹는점(어는점)에 대해 생각해봅시다.
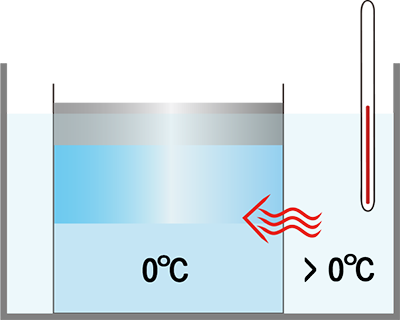
순수힌 물의 녹는점(어는점)은 1기압에서 섭씨 0도입니다. 예를 들어, 섭씨 영하 5도의 얼음 한 덩어리에 아주 천천히 열을 가하면, 온도가 올라갑니다. 그러다가 섭씨 0도가 되면 온도가 올라가지 않고 얼음이 물로 변합니다. 이때 들어간 열은 온도를 높이는데 쓰이지 않고, 얼음이 물로 변하는데 쓰이기 때문입니다. 그래서 얼음이 모두 물이 되기까지는 계속 섭씨 0도입니다. 얼음이 모두 녹아 물이 되었는데도 열이 가해지면 물의 온도가 올라갑니다.
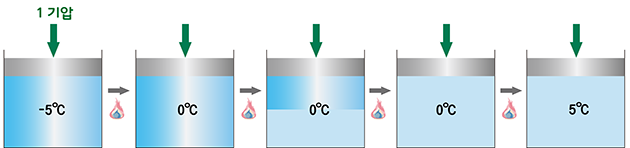
위의 예에서 [얼음/물]은 열을 어디서 얻었을까요? 열은 온도가 높은 곳에서 낮은 곳으로 이동하는 에너지의 한 형태입니다. 따라서 [얼음/물]에 열을 더해주려면, 그것의 주위에 [얼음/물]보다 온도가 높은 물체를 두어여 합니다. 만약 [얼음/물]로부터 열을 빼내고 싶다면, 그것의 주위에 그것보다 온도가 낮은 물체를 두어야 합니다. 열을 천천히 더하거나 빼고 싶다면 [얼음/물]보다 온도를 아주 조금 높거나 낮게 조정해줍니다.
|
|
|
|
|
|
|
|
|
|
|
|
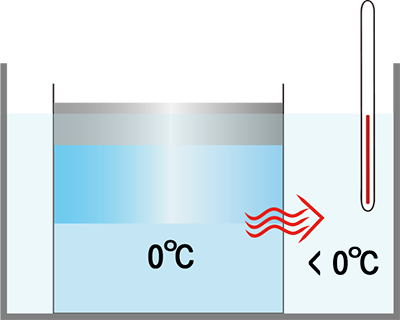
위의 예로부터 알 수 있듯이 녹는점(어는점)은 얼음과 물이 함께 있을 수 있는 온도입니다. 그보다 낮은 온도에서는 시간이 흐르면서 물이 모두 얼음으로 바뀌고, 그보다 높은 온도에서는 얼음이 모두 물로 바뀝니다.

주위의 온도가 섭씨 0도보다 높아 [얼음/물]로 열리 들어가더러도, 얼음과 물이 모두 있는 동안에는 [얼음/물]의 온도는 섭씨 0도입니다. 둘이 함께 있는 동안 들어간 열은 온도는 변화시키지 않고, 상태만 변화시키니까요.

이제 순수한 물이 아닌 소금물이나 설탕물과 같은 수용액의 어는점(녹는점)에 대해 생각해봅시다. 예를 들어, 섭씨 5도의 소금물이 있습니다, 주위의 온도를 낮추어 열을 빼앗아옵니다. 그러면 소금물의 온도가 내려가겠지요. 점점 온도가 내려가다 섭씨 0도에 도달하였습니다. 그런데 얼지 않습니다. 소금물의 농도가 진하면 섭씨 0도보다 훨씬 낮은 온도까지 내려야 업니다.
생기는 고체는 순수한 물입니다. 소금과 같이 얼지 않고 소금물의 성분 중 물만 고체가 됩니다. 소금물의 일부가 얼었을 때 꺼내어 표면을 씻은 후 맛을 보면 맹물이라는 것을 알 수 있을 겁니다. 즉, 소금물은 물보다 어는점(녹는점)이 낮습니다. 그 말은 소금물과 얼음이 같이 있을 때에는 섭씨 0도보다 낮다는 것을 뜻합니다. (이 현상에 대한 과학적 이유는 고등학생이 되면 알 수 있을 것입니다.)

이번 실험에서는 얼음/물, 얼음/소금물, 그리고 얼음/설탕물을 아이스크림 재료로부터 열을 빼앗아주기 위해 사용하였습니다. 따라서 아이스크림 재료보다 온도가 낮을수록 열을 더 빨리, 더 많이 빼낼 수 있습니다. 얼음/설탕물이나 얼음/소금물은 얼음/물보다 더 낮은 온도까지 내려가므로, 아이스크림을 만드는데 더 효과적입니다.
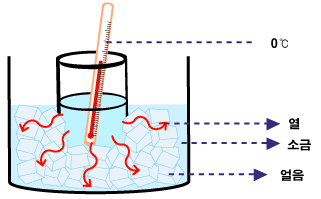
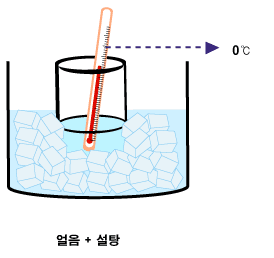
그러면 설탕과 소금의 차이는 무엇일까요? 어는점(녹는점)이 내려가는 데는 물에 녹아 있는 분자 또는 이온의 종류가 무엇인지는 중요하지 않습니다. 종류에 상관없이 몇 개가 있는지가 중요합니다. 설탕이 물에 녹으면 설탕 분자들로 뿔뿔이 흩어집니다. 소금(NaCl)은 물에 녹아 Na+와 Cl-로 나누어지며 물에 녹습니다. 설탕 분자 1개에 비해 NaCl 한 단위는 질량이 1/5도 안 됩니다. 그런데다 물에 녹으면서 Na+와 Cl-로 나누어지므로, 같은 질량이라면 설탕에 비해 소금이 물에 녹을 때 10배 이상 많은 입자들이 생깁니다. 따라서 같은 질량을 비교했을 때 어는점을 낮추는데 소금이 10배 이상 효율적입니다.
 | 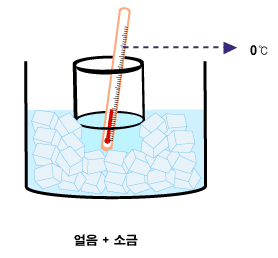 |
어는점을 낮추기 위해 섞은 얼음/소금물과 같은 것을 한제라고 합니다. 얼음/소금물로 만든 한제는 소금과 얼음의 질량 비율이 약 1대3일 때 가장 효과가 좋으며, 최저 영하 21℃까지 온도를 내려가게 할 수 있습니다. 얼음/염화칼슘 수용액으로 만든 한제는 -55℃까지 내릴 수 있다고 합니다.
눈이 왔을 때 염화 칼슘을 뿌려 주는 것도 같은 이유입니다. 눈 위에 염화칼슘을 뿌려주면 대기중의 수증기를 흡수하여 스스로 용해됩니다. 염화칼슘이 녹으면서 주위로 열을 내어놓습니다. 이 열을 흡수한 눈이 녹게 되지요. 그러면 녹은 눈은 염화칼슘과 섞여서 수용액을 만들게 됩니다. 염화칼슘 수용액은 0℃보다 낮은 온도에서 얼기 때문에 밖의 온도가 0 ℃이하로 내려가더라도 소금이나 염화칼슘을 뿌려준 곳은 녹은 눈이 얼지 않고 계속 녹아있는 것입니다.