|
|
준비물 |
|
실험과 관찰 |
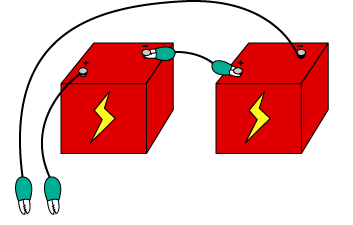
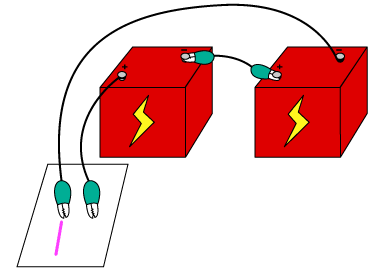
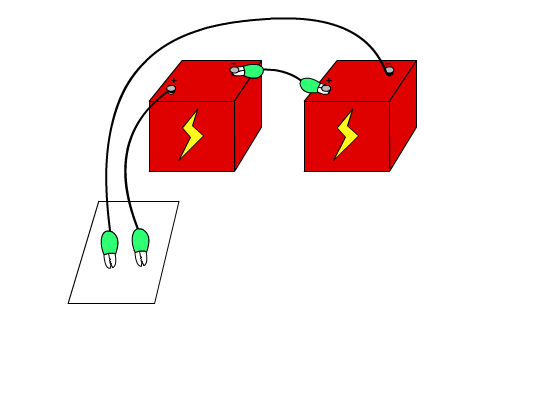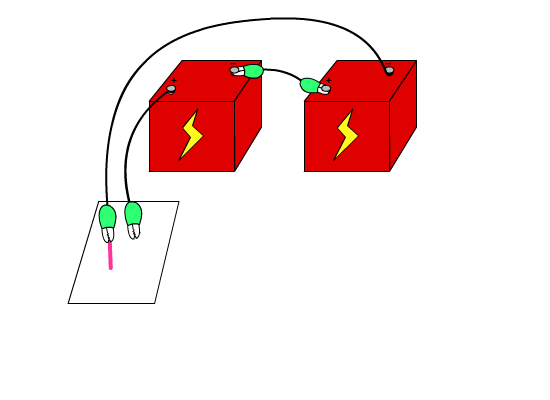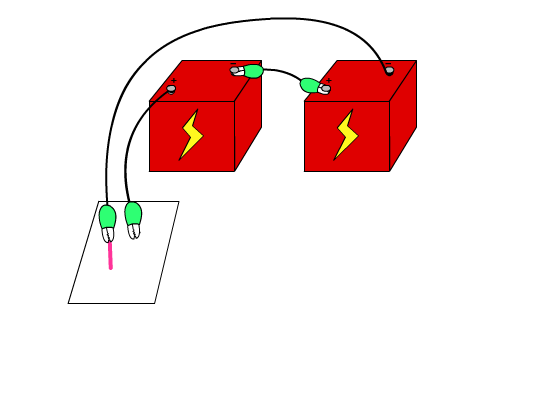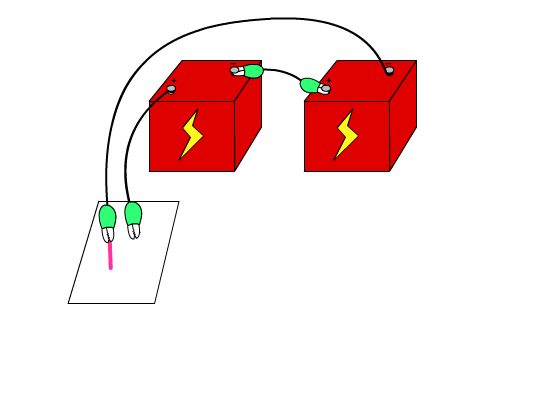
방법 1 1. 1.6V 전지 두 개를 직렬로 연결하고, 전선을 연결하여 (+)과 (-)극을 만든다. 2. 두 개의 전선을 함께 나란히 묶는다
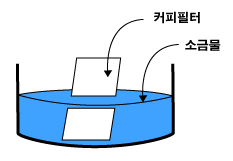
3. 진한 소금물을 만들어 커피 필터에 흠뻑 묻힌다.
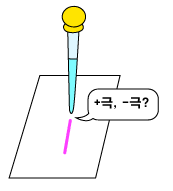
5. 선 위에 페놀프탈레인 지시약을 떨어뜨린다. 어느 극이 그은 선 주위에 색깔의 변화가 있는지 살펴본다.
방법2. 1. 1.6V 전지 두 개를 직렬로 연결하고, 전선을 연결하여 (+)과 (-)극을 만든다. 2. 두 개의 전선을 함께 나란히 묶는다.
3. 진한 소금물을 만들어 커피 필터에 흠뻑 묻힌다.
4. 필터 위에 페놀프탈레인 지시약을 골고루 뿌려준다.
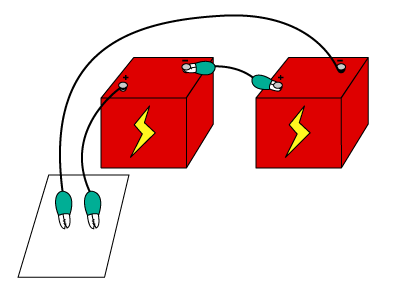
5. 두 개의 전선으로 소금물과 페놀프탈레인이 묻은 커피 필터에 나란히 선을 긋는다.
|
|
왜 그럴까요? |
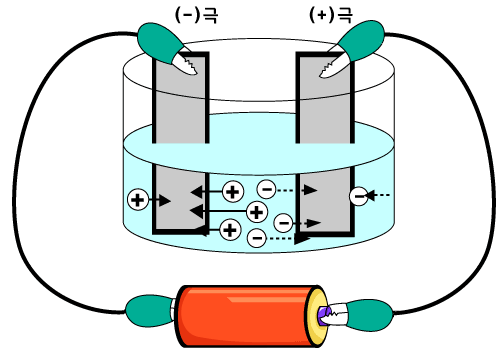
수용액에서 양이온과 음이온으로 있는 물질을 물에 녹인 다음 전원에 연결된 전극을 담그면, (+)전하를 띤 양이온은 (-)극 쪽으로 끌러갑니다. 그런 다음 (-)극으로부터 전자를 받기도 합니다. 어떤 것이 전자를 받는 과정을 '환원'이라고 합니다.
반면, (-)전하를 띤 음이온은 (+)극 쪽으로 끌려갑니다. 그리고 (+)극에 전자를 주기도 합니다. 어떤 것이 전자를 내어놓는 과정을 '산화'라고 합니다.
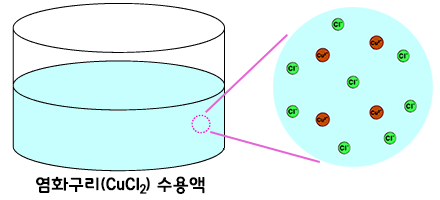
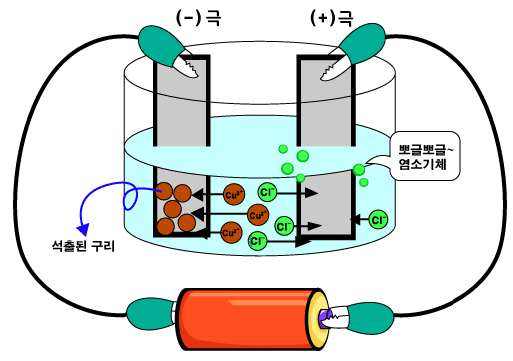
염화구리(CuCl2)를 예로 들어볼까요? 염화구리는 물 속에서 구리 양이온(Cu2+)과 염소 음이온(Cl-)으로 있습니다.
염화구리 수용액에 전원에 연결된 전극을 담그면, 구리 양이온(Cu2+)들은 (-)극으로 움직입니다. 그리고 (-)극으로부터 전자들을 받아 구리 원자(Cu)들이 됩니다. 구리 원자들이 모여있는 것이 고체 구리입니다. 따라서 (-)극의 표면에는 고체 구리가 생기지요.
반면, 염소 음이온(Cl-)들은 (+)극으로 움직입니다. 그리고 (+)극에 전자를 준 다음 둘 씩 모여 염소 분자(Cl2)가 됩니다. 염소 분자들이 많이 모여 있는 것이 염소 기체입니다. 따라서 (+)극에서는 기포가 뽀글뽀글 나옵니다.(* 염소 기체는 유독하므로, 마사지 않도록 합니다. 이 실험에서는 아주 조금 나옵니다.)
소금은 어떨까요? 소금(NaCl)은 물 속에서 나트륨 양이온(Na+)과 염소 음이온(Cl-)으로 존재하지요. 그런데 소금물에 전극을 담가도 (-)극 표면에서 나트륨 금속이 생기지 않습니다.
 |
염화구리와 염화나트륨은 어떤 차이가 있나요? |
두 물질은 비슷해 보이지만 구리와 나트륨에서 아주 큰 차이가 있지요. 구리와 나트륨은 굼속 물질입니다. 금속 물질의 원자들은 전자를 얻기보단 내어놓고 양이온이 되는 성질이 있습니다. 그런데 금속의 중류에 따라 전자를 더 잘 내어놓기도하고, 그렇지 않기도 합니다. 수용액에서 전자를 내어놓는 성질을 '이온화 경향'이라 부릅니다. 이온화 경향이 크다는 것은 양이온으로 있으려는 경향이 크다는 뜻이며, 역으로 그 이온은 전자를 잘 받지 않는다는 뜻입니다. 아래에 전자를 잘 내어놓는 것부터 순서대로 나열하였습니다.

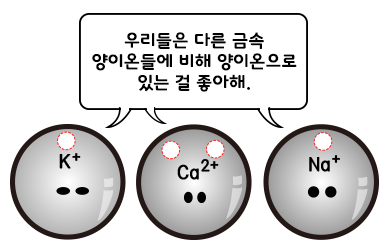
위의 표에서 수소(H)를 기준으로 그것보다 앞에 있는 금속의 양이온은 수용액에서 (-)전극으로부터 전자를 받지 않습니다. 따라서 (-)극 표면에 고체로 달라붙지 않습니다 반면, 수소(H)보다 뒤에 있는 금속의 양이온은 수용액에서 (-)극으로부터 전자를 받습니다. 따라서 (-)극 표면에 고체로 달라붙습니다.
위의 표에서 볼 수 있듯이 구리(Cu) 수소(H) 뒤에 있으므로 Cu2+ 이온은 (-)극으로부터 전자를 받아 (-)극 표면에 고체로 달라붙습니다. 반면, 나트륨(Na)은 수소(H) 앞에 있으므로 Na+ 이온은 (-)극으로부터 전자를 받지 않아, (-)극 표면에 고체로 달라붙지 않습니다.
 |
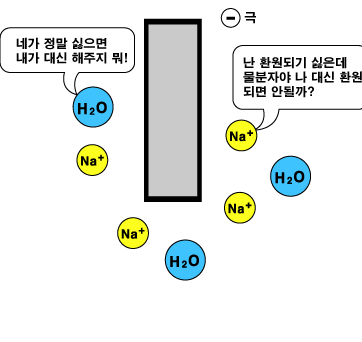
NaCl 수용액에 전류를 흘렸을 때 Cl- 이온이 (+)극에 전자를 주었잖아요. 아무도 전자를 받지 않는다면, 전자들이 어딘가 쌓이는 걸까요? 전자들은 같은 (-)전하를 띠니까 그렇게 함께 모이려고 하지 않을 것 같은데... 그렇다면 누군가 전자를 받아야 할텐데...? |
맞습니다. 누군가 전자를 내어놓으면 누군가 전자를 받아야 합니다. NaCl 수용액에서는 전자를 잘 받지 않는 Na+ 이온 대신 물(H2O)이 전자를 받아 환원됩니다. 그러면 수소기체(H2)를 발생하고 OH- 이온이 만들어집니다. 위의 표에서 기준이 되었던 H가 바로 물의 H입니다.
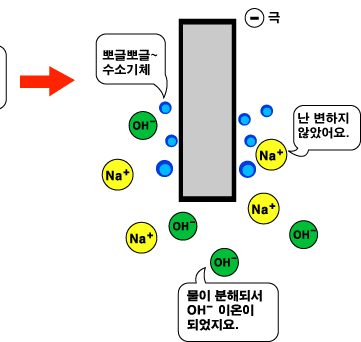
소금물을 흠뻑 적신 종이에 전류를 흘려 줄 때도 전극을 용액에 담그었을 때와 같은 결과가 나타납니다. (+)극에서는 Cl- 이온이 산화되어 염소기체(Cl2)가 발생하고, (-)극에서는 물이 환원되어 수소 기체와 OH- 이온이 만들어지지요.
(-)극 : 2H2O + 2e- → H2 + 2OH- (환원)
(+)극 : 2Cl- → Cl2 + 2e- (산화)
전체반응 : 2NaCl → 2Na+ + 2Cl-, 2H2O + 2Cl-→ H2 + Cl2 + 2OH-
OH- 이온이 더해진 수용액은 염기성이지요. (-)극이 닿는 곳은 염기성이므로, 페놀프 탈레인 용액을 뿌려주면 (-)극 주위에 붉은 색이 나타나지요. 페놀프탈레인 용액은 산성이나 중성에서는 색을 나타내지 않지만, 염기성에서는 붉은색을 나타내거든요. 소금물은 중성이니까 페놀프탈레인을 넣어도 색깔의 변화가 없다가, 전류가 흐르면서 만들어진 OH- 이온 때문에 붉은색이 되는 것입니다.
붉은 선을 없애고 싶어요. 어떻게 하면 될까요? 산성용액 등을 이용해서 염기성을 중화시키면 되겠지요. 식초를 뿌려보세요. 식초가 염기성을 중화시키면 중성이 되고 중성은 페놀프탈레인 용액에서 색깔을 나타내지 않지요.