|
|
|
준비물 |
|
|
실험과 관찰 |
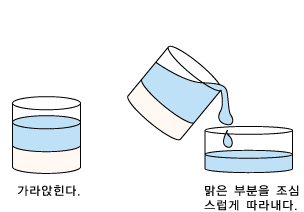
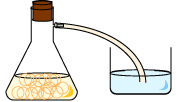
1. 수산화칼륨슘을 물에 넣어 오랫동안 저어 줍니다.
2. 한참 세워두면 녹지 않은 석회가루가 가라앉습니다 이때 위의 맑은 물만 따라냅니다.(석회수)
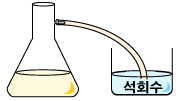
3. 가지달린 삼각플라스크에 식초를 넣습니다.
4. 삼각플라스크가지에 고무관을 연결해 한쪽을 석회수에 담가둡니다.
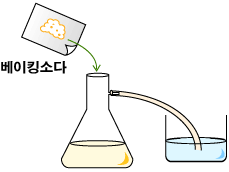
5. 준비한 베이킹소다를 식초가 담긴 삼각플라스크에 넣고 입구를 고무마개로 막는다.
6. 고무관이 담긴 석회수를 관찰한다.
 |
|
왜 그럴까요? |
우리 주변에서 흔히 볼 수 있는 이산화탄소의 재료는 탄산음이온을 가지는 물질입니다. 탄산음이온은 1개의 탄소원자와 3개의 산소원자로 이루어져 있으며 -2의 음전하를 띄고 있습니다.

 |
자~ 문제하나. 탄소원자는 6개의 전자, 산소원자는 8개의 전자를 가지고 있습니다. (원자 안에 있는 양성자 수와 전자 수가 같아 원자는 전하를 띄지 않지요,) 탄산음이온 하나에는 전자가 모두 몇개 있나요?
|
 |
탄소 1개와 산소 3개에 들어 있는 전자를 모두 더하면 |
 |
'2-'가의 음이온이라는 것은 원자들이 가지 전자들에 더해 전자가 2개 더 있다는 뜻입니다. 따라서 답은 '32개'입니다. |
베이킹소다의 주성분은 탄산나트륨(탄산소다라고도 부릅니다)입니다. 탄산나트륨은 탄산음이온과 나트륨 양이온(Na+)이 엄청나게 많이 모여 이루어진 것입니다.
 |
또 문제. 모든 물질은 겉으로 보기엔 전하를 띄지 않습니다 그렇다면 탄산나트륨안에 있는 탄산음이온의 수 : 나트륨 양이온의 수의 비율은 얼마일까요
|
 |
탄산 음이온은 '-2'가, 나트륨 양이온은 '+1'가이므로, 탐산 음이온 1개 당 나트륨 양이온 2개가 있어야 전하가 '0'이 되겠어요. |
 |
정답! 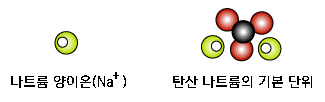 그렇다면 탄산나트륨의 화학식은?
|
 |
탄산 음이온(CO32-) 1개와 나트륨 양이온(Na+) 2개이므로 예시 중 고르라면, |
 |
맞았습니다.
(1) 양이온을 앞에 쓰고, |
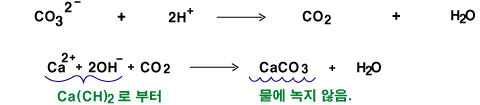
이 탄산 음이온은 산으로부터의 수소양이온(H+)과 반응하여 이산화탄소를 만들어내지요.
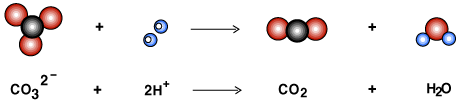
조개껍질, 분필, 달걀껍질에는 탄산칼슘(CaCO3)이 들어 있습니다. 탄산 음이온과 칼슘 양이온(Ca2+)으로 이루어진 물질이지요. 이 물질도 탄산 음이온을 가지고 있으므로 산과 반응시키면 이산화탄소 기체가 생겨나지요. 뽀글뽀글~~

이 이산화탄소는 무색 무취의 기체라 우리의 감각으로 알아 볼 수가 없지요. 이산화탄소 기체는 석회수에 통과시켜보면 확인할 수 있습니다.
왜냐하면 석회수는 수산화칼슘(Ca(OH)2)를 물에 녹여 놓은 것인데 Ca2+이온과 OH-이온으로 물속에 녹아 있지요. 여기에 CO2기체를 통과시키면 다음과 같은 화학반응이 일어나 탄산칼슘(CaCO3)를 만듭니다. 그런데 이 탄산칼슘은 물에 녹지 않아 석회수가 뿌예지지요. 분필가루를 물에 타놓은 것처럼이요. (반응식을 외우지는 마세요.)