|
|
|
준비물 |
|
|
실험과 관찰 |
1. 물 200ml를 비이커에 담고 온도계를 꽂는다. 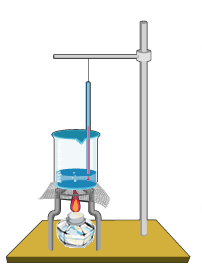 3. 끓기 시작한 온도와 온도가 일정하게 유지되는 온도를 기록한다. |
|
실험 결과 |
||
순수한 물 |
|
|
|
소금물 |
|
|
|
||
|
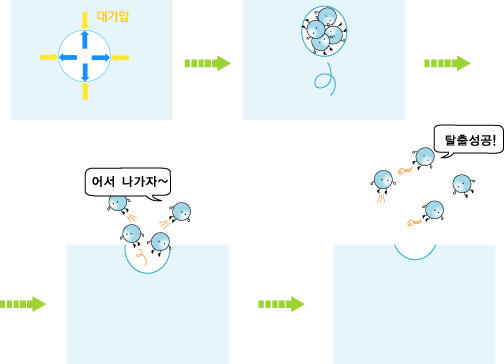
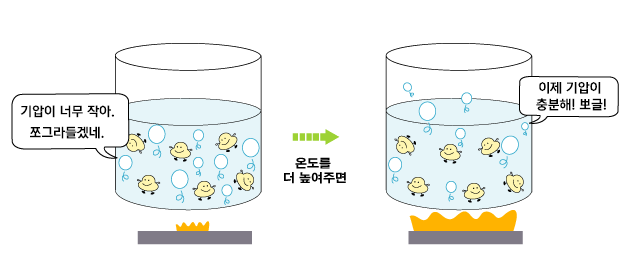
물이 끓을 때 물 속에서 볼 수 있는 작은 방울들은 기체 상태의 물인 수증기 덩어리들입니다. 이러한 기체 덩어리를 기포라고 부릅니다.
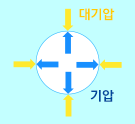
기포 안의 기체는 물과 수증기의 경계면에 압력을 가합니다. 물 위에서는 대기압이 누르고 있습니다. 따라서 물 쪽에서는 경계면에 대기압 크기의 압력을 작용합니다.
물이 끓는다는 것은 물 속에서 생긴 기포가 위로 올라와 공기 중으로 빠져나가는 것입니다. 뽀끌! 만약 기포 안의 기압이 대기압보다 작다면, 기포는 물 속에서 다시 쪼그라들어 사라집니다. 바깥에서 더 큰 압력으로 미니까요. 기포가 사라지지 않고 물 위로 올라오기 위해서는 기포 안의 기압이 대기압과 같거나 커야 합니다. 기포 안의 압력과 대기압이 같아지는 온도를 '끓는점'이라고 합니다. 물의 경우, 섭씨 100도에서 기포 안의 기압이 1기압이 됩니다. 따라서 대기압이 1기압이라면, 물은 섭씨 100도에서 끓습니다. 흔히 물의 끓는점이 섭씨 100도라고 하는 이유가 바로 이것입니다. 그리고 물이 끓는 동안에는 온도가 변하지 않고 일정하게 유지됩니다. | ||
 |
||
|
대기압이 커지면 물의 끓는점은 어떻게 될까요? |
||
 |
||
|
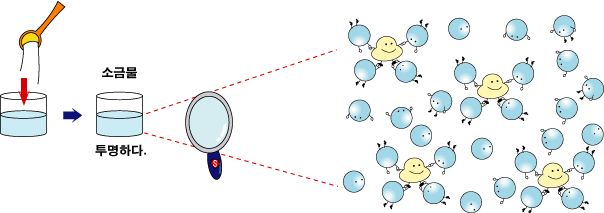
이제 소금물에서는
어떤 일이 일어나는지 살펴볼까요? |
||
 |
||
|
그리고
이 소금 이온들은 물이 기화하는 것을 조금 방해합니다. 그래서 같은 온도라면 물에 비해 수증기가 되는 양이 적어 기포 안의 기압이 작아집니다. |
||
 |
||
|
||
|