|
▶ 녹음(융해)과 얼음(응고) |
|
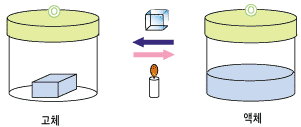
얼음을 가열하면(열을 가하면) 물이 되고, 물을 충분히 낵각하면(열을 빼앗으면) 얼음이 됩니다. 고체가 액체로 되는 과정을 녹음(융해) 액체가 고체로 되는 과정을 얼음(응고)라고 합니다.
물이 냉각되어 얼음이 될 때 온도의 변화에 대해서는 냉아래 링크를 참조합니다.
물질이 고채에서 액체가 되는 과정(융해), 또는 액체에서 고체가 되는 과정(응고)에 대해 조금더 자세히 살펴봅시다.
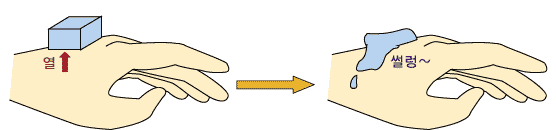
A. 융해와 응고에 따른 열의 이동 고체 상태의 물질을 천천히 냉각시킬 때 고체에서 액체로 되기 사적하는 온도를 녹는점이라고 합니다. 반대로, 액체 상태의 물질을 천천히 냉각시킬 때 고체로 되기 시작하는 온도를 어는점이라고 하는데, 녹는점과 어는점은 같은 온도입니다. 1기압 하에서 여러 순물질의 녹는점(또는 어는점)은 각기 다릅니다. 따라서 이 녹는점(또는 어는점)은 한 순물질의 특성이므로, 미지의 순물질의 녹는점을 측정하면 그 물질이 무엇인지 대략 알아낼 수 있습니다. 예를 들어, 물의 녹는점은 1기압 하에서 섭씨 0도 입니다. 한 물질이 고체에서 액체로 되려면 외부에서 열을 공급해 주어야 하지요. 따라서 한 물질이 고체에서 액체로 될 때 그 주위는 열을 빼앗깁니다. 더운 여름에 열이 나면 얼음을 먹지요. 그러면 얼음이 우리 몸으로부터 열을 빼앗아가 물이 됩니다. 이 때 우리 입 안은 열을 빼앗기므로 온도가 내려가므로 우리는 시원하다고 느끼는 거지요.
여러 물질 1g이 녹을 때 필요한 열의 양이 다르릅니다. 물의 경우 1g의 얼음이 물이 될 때 80cal 정도의 열이 필요합니다.(cal로 열의 양을 나타내는 단위입니다.) 반면, 어는 과정에서는 물질이 주위에 열을 내어 놓습니다. 따라서 물질을 얼게 하려면 주위에서 물질의 열을 빼앗아 주어야 하지요. 1g의 물을 얼음으로 만들려면 80cal 정도의 열을 빼앗아 주어야 합니다.
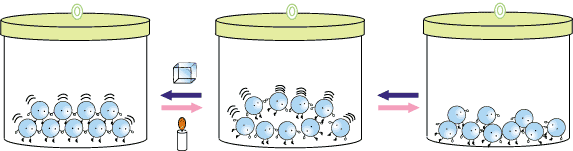
B. 융해와 응고에 따른 분자 배열 변화 고체 상태와 액체 상태에서 분자들의 배열은 어떻게 다를까요? 열이 가해지면 분자들은 에너지를 얻고, 그 결과 운동을 더 활발하게 합니다. 고체 상태에서 제 자리에서 진동만 하던 분자들이 열을 얻으면 진동의 폭이 더 커집니다. 열을 계속 얻어서 충분히 많아지면 정해진 자리를 떠나 자유롭게 움직일 수 있게 됩니다. 이 상태가 액체 상태입니다. 액체 상태에서도 다른 분자들이 잡아당기는 힘(인력)을 이겨낼 만큼 에너지가 많지는 않아서, 분자들끼리 붙어서 움직인답니다. 액체를 냉각하여 얼릴 때에는 반대의 과정이 일어납니다.
C. 융해와 응고에 따른 질량의 변화 얼음이 녹아 물이 될 때 물 분자들은 배열만 다르게 할 뿐 없어지거나 새로 생기지 않습니다. 물이 얼음이 될 때도 마찬가지이구요. 따라서 물질이 융해하거나 응고할 때 질량은 변하지 않습니다. 만약 구슬 1개의 질량이 1g이라면
분자들이 규칙적으로 배열한 고체 모형이나 분자들이 뒤죽박죽인 액체 모형의 질량 모두 10g입니다.
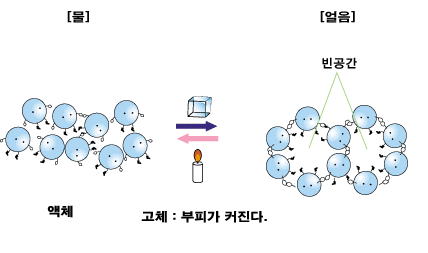
D. 융해와 응고에 따른 부피의 변화 고체 상태에서의 분자 배열과 액체 상태에서의 분자 배열이 다를므로, 각 상태에서 분자들의 배열이 빽빽한 정도가 다르겠지요. 보통의 경우 액체 상태에서 고체 상태에 비해 분자들이 더 자유롭게 움직이므로 액체 상태에서 고체상태에 비해 분자들이 덜 빽빽하게 배열되어 있답니다. 즉, 대부분의 경우 고체 상태에 비해 액체 상태에서 분자들 사이의 빈 공간이 많고, 따라서 부피가 더 큽니다.
 ▲ 사염화탄소
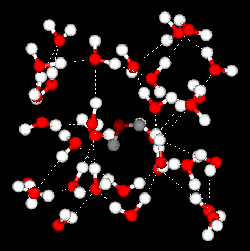
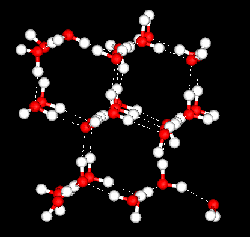
그런데 물은 아주 특별합니다. 물은 얼음이 되면서 6개의 분자가 6각형을 이루는 구조를 갖습니다. 이 구조는 아래 그림에서 보는 것처럼 분자 사이에 많은 빈 공간을 갖습니다.
아래 그림은 얼음과 물 안에서의 분자들이 배열된 모습을 보여주는 모형입니다. 빨간 공은 산소 원자이고 하얀 공은 수소원자입니다.
(출처 : 미국 뉴욕대학)
그러니까 물은 얼음이 되면서 부피가 커집니다. 물에서 얼음으로 바뀌면서 질량은 같은데 부피가 증가하므로 밀도도 변합니다. 즉, 밀도
= 질량/부피
이고, 질량이 같을 때 얼음의 부피가 더 크므로 얼음의 밀도가 물 보다 작습니다.
물이 얼면서 부피가 커지고, 따라서 밀도가 작아지기 때문에 발생하는 현상이 많습니다. 예를 들어, 꽉 찬 물병을 얼리면 터지거나, 겨울에 수도관이 파열되는 것은 얼음이 물 보다 부피가 크기 때문이지요.
이 사실은 물고기의 생활에도 영향을 줍니다. 아래에서 알아보세요.
|