|
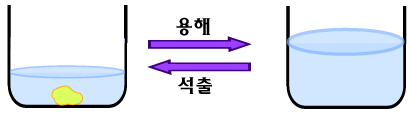
▶ 용해와 석출 |
|
설탕을 물에 녹였다가 물을 증발시키면 다시 설탕 고체가 생기지요. 이것은 주어진 온도에서 일정양의 물에 설탕이 무한대로 녹지 않고 최대한 녹을 수 있는 설탕의 양이 있기 때문입니다. 100g의 물에 녹는 설탕의 양을 그 온도에서의 설탕의 용해도라고 합니다. 25°C에서 물에의 설탕의 용해도는 210g 정도입니다. A. 용매의 양이 변하면 어떻게 될까? 그렇다면 25°C에서 물 50g에 녹을 수 있는 설탕의 최대량은 얼마일까요? 물의 양이 반으로 줄었으므로, 최대한 녹을 수 있는 설탕의 양도 반으로 줄어 105g 정도입니다. 따라서 100g의 물에 210g의 설탕을 녹여 공기 중에 놓아두어 물이 50g 증발되고 나면 105g의 설탕이 더 이상 녹아 있지 못하고 고체로 되지요. 이렇게 고체가 물(용매)에 녹았다가 다시 고체로 되는 과정을 석출이라고 합니다.
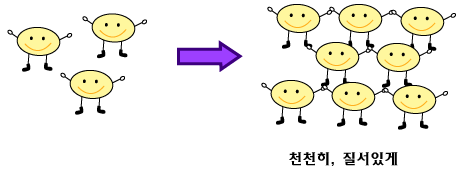
B. 온도가 변하면 어떻게 될까?? 100g의 물에 녹는 설탕의 양은 온도가 달라지면 변합니다. 설탕은이 물에 녹을 때 온도가 올라가면 용해도도 커집니다. 예를 들어, 설탕은 100g의 물에 25°C에서는 210g 정도, 80°C에서는 360g 정도 녹습니다. 25°C, 100g의 물에 360g의 설탕을 더하면 어떤 일이 생길까요? 25°C에서 물 100g에 녹는 설탕의 최대량이 210g 정도이므로 150g 정도는 녹지 않고 고체로 있습니다. 이 설탕과 물의 혼합물을 80°C로 끓이면 어떻게 될까요? 80°C에서 100g의 물에 녹을 수 있는 설탕의 최대량이 360g이므로, 녹지 않고 있던 설탕이 모두 녹습니다. 이제 설탕물을 25°C로 다시 식히면 어떤 일이 일어날까요? 다시 물 100g에 녹을 수 있는 설탕의 최대량이 210g이므로, 150g의 설탕이 다시 고체로 석출됩니다. 80°C로 끓였다가 아주 천천히 식히면 여기저기 고체로 석출하지 않고 가장 먼저 생긴 작은 덩어리에 설탕분자들이 질서있게 달라붙어 큰 덩어리 설탕을 만듭니다. 이렇게 만들어진 큰 고체 덩어리는 대개 투명합니다. 크고 투명한 고체 덩어리를 '결정'이라고 부릅니다.
때로는 25°C로 식혀 주어 과량-용해도 이상-의 설탕이 녹아 있음에도 불구하고 고체로 석출되지 않는 경우도 있습니다. 이것은 설탕 분자들이 매끈한 표면에는 잘 안 불기 때문인데, 이 때 아주 작은 설탕 덩어리나, 표면이 꺼칠한 아주 작은 것을 넣어주면 설탕 분자들이 그것을 중심으로 모여 고체가 됩니다.
이렇게 고체를 용매에 녹였다가 용매의 양(증발에 의해) 또는 온도를 변화시켜 다시 고체로 석출시키는 과정을 '재결정'이라고 부릅니다. |