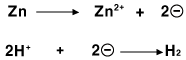|
▶ 산화와 환원 반응의 이용: 화학전지 |
|
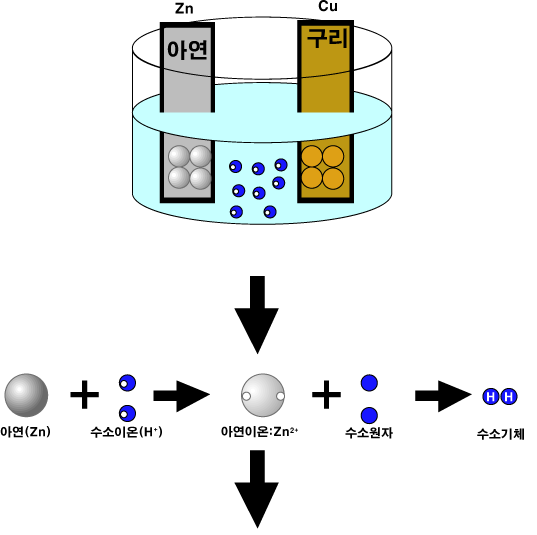
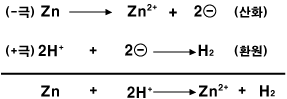
아연(Zn)은 산성 수용액에서 수소 양이온(H+)에게 전자를 주고 아연 양이온(Zn2+)이 됩니다. 반면, 구리(Cu)는 수소 양이온에게 전자를 주지 않고 그대로 있습니다.
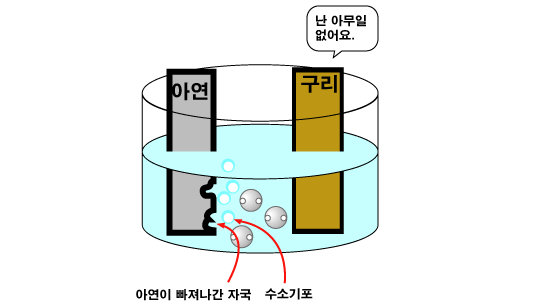
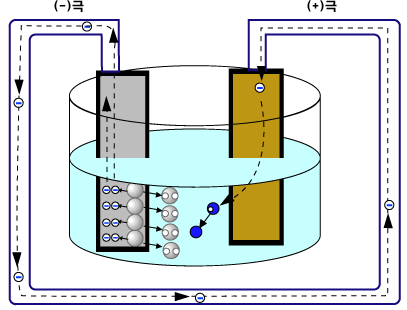
그러면 구리판과 아연판을 산성 수용액에 함께 담께근 후, 두 판을 전선으로 연결하면 어떤 일이 일어날까요? 아연원자(Zn)가 전자 2개를 직접 수소 양이온(H+)에게 주기도 하지만, 전자를 아연판에 남기고 양이온이 되어 용액으로 녹아들어가기도 합니다. 그러면 아연판에는 (-)전하가 많아집니다. 이 아연판과 구리판이 연결되어 있다면, 전자들은 (-)전하가 많이 쌓인 아연판에서 빠져나와 도선을 통해 구리판 쪽으로 이동합니다. (-)전하를 띤 전자는 (-)전하가 많이 쌓인 곳을 싫어하기 때문입니다. 이렇게 구리판에 도착한 전자들은 수소 양이온(H+)에게 전달됩니다.
전하가 이동하는 것을 전류라고 합니다. [아연판 - 산성 수용액 - 구리판]의 아연과 구리를 도선으로 연결할 때 전류가 흐르므로, [아연판 - 산성 수용액 - 구리판]는 전지입니다. 이때 아연처럼 양이온이 되기 쉬운 금속판은 (-)극이 되고, 양이온이 되기 어려운 금속판은 (+)극이 되지요. 실제로 전자는 (-)극에서 (+)극으로 이동하지만, 전류의 방향을 (+)에서 (-)극으로 약속하였습니다. 그래서 전자의 이동 방향과 전류의 방향은 반대입니다. 전자의 이동이 일어나는 산화와 환원 반응을 이용해서 만든 전지를 화학 전지라고 합니다. 특히, 묽은 황산에 구리판과 아연판을 넣어 만든 전지는 볼타전지라고 합니다.
간단한 화학전지를 만들어 보고싶다면, 아래 링크로 가보세요.
|