|
▶ 산성 수용액과 염기성 수용액 자세히 보기 |
|
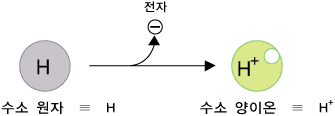
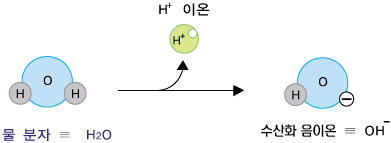
앞의 절 산성 수용엑과 염기성 수용액에서는 산성 수용액과 염기 수용액이 보여주는 성질을 살펴보았습니다. 이 절에서는 산성 수용액끼리의 공통점, 염기성 수용액끼리의 공통점, 그리고 산성 수용액과 염기성 수용액의 차이점을 분자 수준에서 알아봅니다. 중성의 물에는 아주아주 적은 양의 H+ 양이온과 OH- 음이온이 있습니다. 수소 양이온(H+)은 수소 원자(H)로부터 전자가 하나 빠져나간 것입니다. 수산화 음이온(OH-)은 물 분자로부터 H+이온이 빠져나간 것입니다.
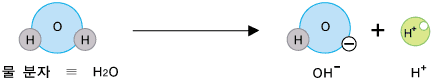
H+ 이온과 OH- 이온이 어디서 생긴 거냐구요? 바로 물로부터 생깁니다. 물에 있는 수많은 물 분자 중 아주 일부분이 다음과 같이 나누어집니다.
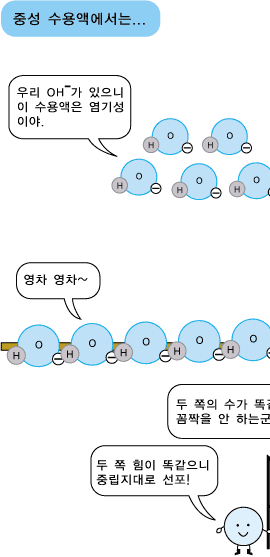
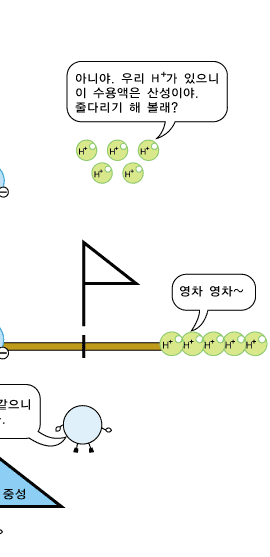
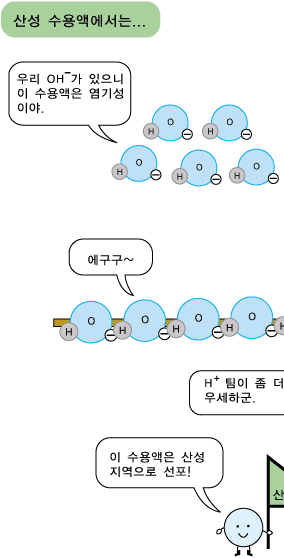
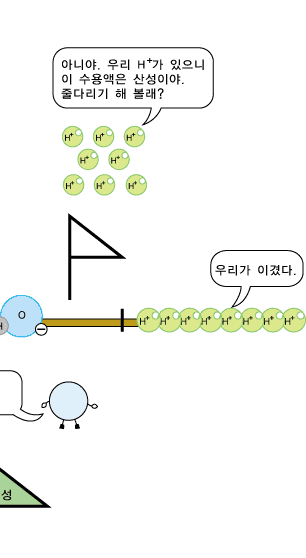
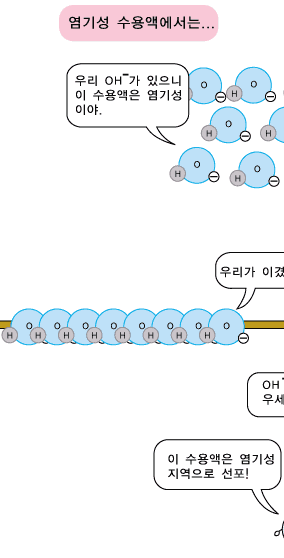
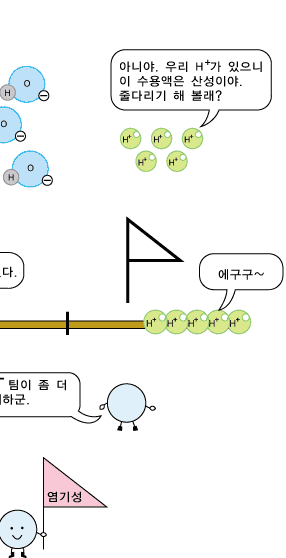
물분자 하나로부터 H+ 이온과 OH- 이온이 각가 하나씩 생기므로 중성의 물에서는 두 이온의 수가 서로 같습니다. 따라서 두 이온의 농도도 같습니다. 어떤 수용액이 산성, 중성 또는 염기성인지는 H+ 이온과 OH- 이온의 상대적인 수 또는 농도에 따라 정해집니다. 신맛이 나는 산성 수용액에서는 수소 양이온(H+)이 수산화 음이온(OH-)보다 더 많이 들어 있습니다. 반면, 염기성 수용액에서는 수산화 음이온(OH-)이 수소 양이온(H+)보다 더 많이 있습니다. 그러니까 산성 수용액의 특징을 내는 것은 수소 양이온(H+), 염기성 수용액의 특징을 내는 것은 수산화 음이온(OH-)이라고 볼 수 있습니다.
산성 수용액에도 OH- 이온과 H+ 이온이 모두 있지만, OH-이온보다 H+ 이온의 수가 더 많아 H+의 성질이 드러나 보입니다.
염기성 수용액에도 OH- 이온과 H+ 이온이 모두 있습니다. 그런데 염기성 수용액에는 OH- 이온의 수가 H+ 이온의 수보다 더 많아 OH-의 성질이 드러나보입니다.
정리해 봅시다. 모든 수용액에는 H+ 이온과 OH- 이온이 항상 같이 있습니다. 두 이온이 같은 수(농도)로 있으면 수용액은 중성의 성질을 나타내고, H+ 이온의 수가 OH- 이온의 수보다 많으면 용액은 산성의 성질을 나타냅니다. 그리고 OH- 이온의 수가 H+ 이온의 수보다 많으면 염기성의 성질을 나타냅니다. 그러니까 용액의 산성-염기성은 두 액성을 나타내는 H+와 OH-의 수에 의해 결정되는 것이 아니고, 두 이온의 수의 차이에 의해 결정되는 것입니다. 우리 주위에서 일어나는 거의 모든 자연 현상은 이렇게 여러 요인의 세기의 차이에 의해 좌우된답니다. |