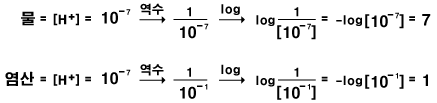|
▶ 수소 이온 지수(pH) |
|
물은 중성으로, 같은 수의 H+ 이온과 OH- 이온이 있습니다. 그렇다면 이 이온들은 물 속에 얼마나 많이 들어있는 걸까요? 물 1L 속에는 H+와 OH-가 각각 10-7몰 들어 있습니다. '몰'은 분자같이 아주아주 작은 입자들을 세는 묶음 단위입니다. 연필 12개를 1다스라고 부르듯이, 아주아주 작은 입자 600,000,000,000,000,000,000,000개 묶음을 1몰이라고 합니다. '0'이 23개 있으므로, 6x1023이라고 표현하기도 합니다. 그리고 10-7은 1/1,0000,000배라는 뜻입니다. 용액의 진하기(농도)를 나타내는 방법 중 몰농도라는 것이 있습니다. 이것은 수용액 1L에 몇 몰의 용질이 녹아 있는지를 나타내는 것입니다. 예를 들어, 설탕물 1L에 설탕 분자 6x1023개(1몰)가 들어 있으면 1M이라고 합니다. 몰농도의 정의는 다음과 같습니다. 몰농도 = 용질의 몰 수 / 용액의 부피(L) 물에 있는 수소 이온의 농도를 몰농도로 표현하면, 10-7M입니다. 우리 주위에서 흔히 쓰는 강한 산성인 염산의 수소 이온 농도는 1x10-1M 정도입니다. 반면, 강한 염기성인 수산화나트륨 수용액의 수소 이온 농도는 1x10-13M 정도입니다. 용액이 산성인지 염기성인지는 수소 이온의 농도로 결정이 됩니다. 그런데 수소 이온 농도는 값이 너무 작고, 또 음의 지수로 되어 있어서 불편합니다. 수소 이온 농도를 간편하게 표시해서 '산성'인지 '염기성'인지 쉽게 알 수 있도록 pH라는 기호를 사용합니다. p는 power, H는 수소 이온 농도를 나타냅니다. 그리고 pH는 수소 이온 지수라고 합니다.
pH는 수소 이온 농도의 역수를 취하고, 다음으로 역수의 상용 대수(log)값입니다.
물과 1x10-1M 염산의 pH값을 계산해 볼까요? 먼저 순수한 물에서의 수소이온 농도는 10-7M 이므로, 역수는 107입니다. 107의 log값은 7입니다. 따라서 물의 pH는 7입니다. 1x10-1M 얌산의 경우 농도의 역수는 10, 그리고 그것의 log 값은 1임,로. pH는 1이 됩니다.
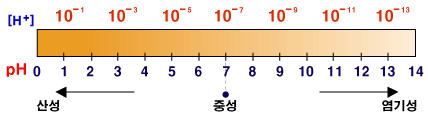
우리 주위에서 흔히 보는 물질의 pH 범위는 0-14 정도입니다. 중성인 순수한 물의 pH 7을 기준으로 7보다 작으면 산성, 7보다 크면 염기성이라고 합니다. pH값이 작을수록 산성이 커지고, pH 값이 클수록 염기성이 커집니다.
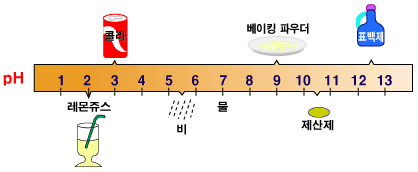
우리 주위의위 여러 물질들의 pH는 얼마나 될까요? 인간의 몸은 완충용액에 의해 pH가 7.04의 중성, 피부는 4.0 정도, 그리고 위는 1.5 정도의 산성을 유지합니다. 산성비라고 것은 정도에 따라 다르지만, 보통의 경우 pH가 5.4 이하인 빗물을 말하지요. 식초는 pH 2.8, 오렌지 쥬스는 3.5, 우유는 6.5, 베이킹 파우더는 pH9, 제산제는 10.5 정도입니다.
|