|
▶ 산 - 염기 중화 반응 |
|
산성 수용액은 신 맛이 나는 특징이 있습니다. 그리고 여러 금속과 대리석과 반응합니다. 이러한 산성 수용액의 특징은 수소 양이온(H+) 때문입니다. 염기성 수용액은 떫은 맛이 나고, 미끌미끌한 특징이 있습니다. 그리고 여러 금속과 대리석과 반응하지 않습니다. 이러한 염기성 수용액의 특징은 수산화 음이온(OH-) 때문입니다. 그리고 중성인 물은 산성 또는 염기성 수용액의 특징이 없습니다. 그리고 수소 양이온(H+)과 수산화 음이온(OH-)이 같은 수(같은 농도)로, 아주아주 낮은 농도로 있습니다. 그렇다면 산성 수용액과 염기성 수용액을 섞으면 어떤 일이 일어날까요? 알아봅시다. 물에 녹아 염기성 수용액을 만드는 제산제를 산성 수용액인 식초에 넣고 관찰합시다.(제산제는 거품을 내면서 물에 천천히 녹습니다.) 양배추 지시약을 몇 방울 떨어뜨려 옹액의 산성-염기성을 색으로 보여주도록 하였습니다. 두 수용액 중 왼쪽은 비교를 위해 제산제를 넣지 않고 처음 상태로 둔 것입니다. 양배추 지시약의 색은 아래 그림을 참조하세요.
(이미지 출처: ttps://mylespower.co.uk/2012/04/06/homemade-ph-indicator/)
산성을 띠는 식초와 염기성 수용액이 더하면 산성이 점점 약해지다가 중성 또는 약한 염기성 수용액이 되었습니다.
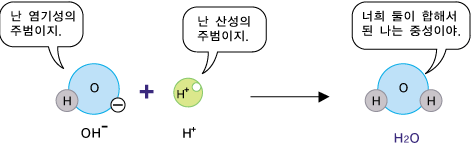
서로 반대되는 두 성질을 섞어 이쪽 성질과 저쪽 성질을 모두 약하게 만드는 것을 중화라고 합니다. 산-염기 중화반응은 산성 수용액과 염기성 수용액을 섞었을 때 산성 수용액의 산성과 염기성 수용액의 염기성이 줄어드는(약해지는) 것을 말합니다. 산성, 중성, 염기성은 수용액에 사용되는 말이므로, 산-염기 중화 반응은 산과 염기 반응이 아니고, 산성 수용액과 염기성 수용액의 반응을 말합니다. 그러면 산성과 염기성이 약해지는 이유는 무엇일까요? 수용액이 산성을 띠는 이유는 H+ 때문이지요. 따라서 산성을 약해지는 것은 H+의 농도가 줄어들었다는 뜻입니다. 즉, 일부 H+가 없어진 것입니다. 수용액이 염기성을 띠는 이유는 OH- 때문이므로, 염기성을 약해졌다는 것은 OH-가 일부 없어졌다는 것입니다. H+와 OH-가 동시에 없어졌다면? 둘이 합해져서 물 분자가 된 것입니다.
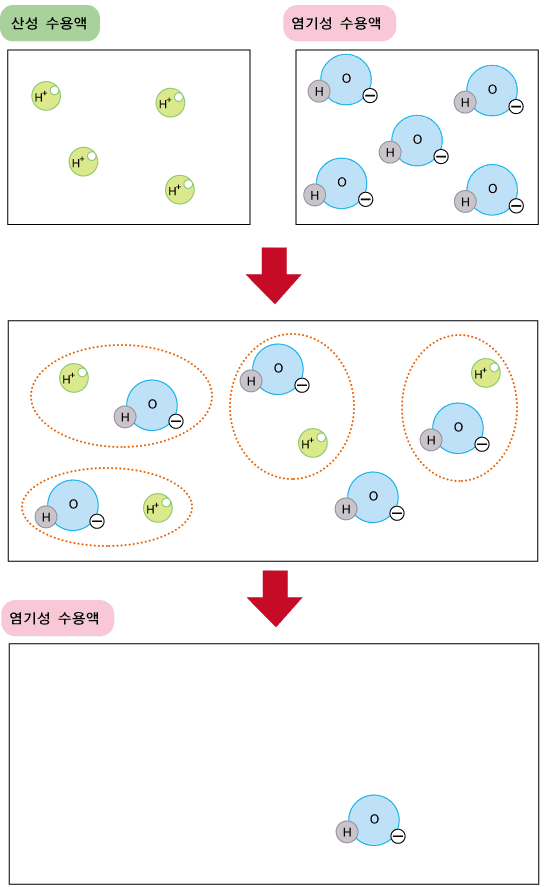
즉, 염기성의 원인이 되는 OH-와 산성의 원인이 되는 H+가 합쳐져서 산성도 아니고 염기성도 아닌 중성의 물이 되니까 산성과 염기성이 동시에 약해지는 것입니다. 만약, 산성 수용액의 산성에 비해 염기성 수용액의 염기성이 같다며, 두 용액을 섞은 후 전체 수용액은 중성이 됩니다. 반면, 산성 수용액의 산성에 비해 염기성 수용액의 염기성이 더 크다면 두 용액을 섞은 후 전체 수용액은 원래의 염기성보다 약한 염기성이 됩니다. 아래 그림의 예에서 섞기 전과 섞기 후의 H+와 OH-의 수를 비교해보세요.(산성 수용액에서는 OH-의 농도가 아주아주 낮고, 염기성 수용액에서는 H+의 농도가 아주아주 낮으므로, 아래 그림에서 생략하였습니다.)
산성 수용액과 염기성의 수용액을 섞었더니 산성은 사라지고 염기성은 약화되었지요? 반대로 산성 수용액의 산성에 비해 염기성 수용액의 염기성이 작다면, 섞은 후 전체 용액은 약한 산성이 됩니다. 이렇게 산성 수용액과 염기성 수용액을 섞을 때는 섞는 산성 수용액과 염기성 수용액의 양에 따라 섞은 후의 수용액이 산성이 되기도 하고 중성, 또는 염기성이 되기도 하지만 항상 섞기 전의 수용액들의 산성 또는 염기성에 비해 약해집니다.
산성 수용액과 염기성 수용액은 우리 생활 속에 널리 퍼져 있고, 이들 사이의 중화반응의 예도 우리 생활에서 많이 찾아 볼 수 있답니다. 위에 산이 너무 많아 속이 쓰릴 때 먹는 제산제, 벌레 물렸을 때 산성인 벌레 독을 중화 시키는 암모니아수, 등의 예를 아래에서 알아 보세요.
|