|
▶ 염기 |
|
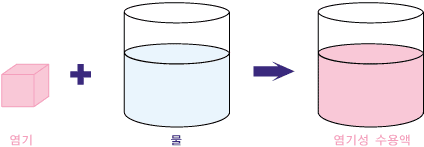
수용액이 산성, 중성, 또는 염기성을 띄는 것은 물에 녹아있는 용질 때문입니다. 그러니까 물에 녹아있는 용질의 종류에 따라 그 용질이 물에 녹아 만드는 용액이 산성이 되기도 하고, 중성이 되기도 하며, 때론 염기성이 되기도 하지요. 이때 물에 녹아 염기성 수용액을 만드는 물질을 염기라고 합니다.
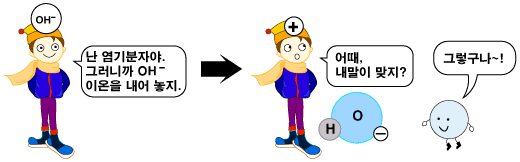
이렇게 염기라고 분류되는 물질들이 물에 녹아 염기성 수용액을 만든다는 것은 무엇을 의미할까요? 그것은 염기라고 분류되는 물질에는 공통점이 있기 때문이지요. 앞 절에서 알아보았 듯이, 떫은 맛이 나고 미끌미끌한 염기성 수용액에는 수산화 음이온(OH-)이 수소 양이온(H+)보다 많이 있습니다. 두 이온이 같은 수로 있는 물에 염기가 녹으면, 수산화 음이온(OH-)을 내어놓습니다. 그 결과, 수산화 음이온(OH-)이 수소 양이온(H+)보다 많아집니다. 염기는 수산화 음이온(OH-)을 가지고 있을 수도 있고 그렇지 않을 수도 있습니다. 수산화 음이온을 가지고 있는 염기는 물에 녹으면서 가지고 있던 OH- 이온을 내어놓습니다. 예로는 수산화 나트륨(NaOH)이 있습니다.
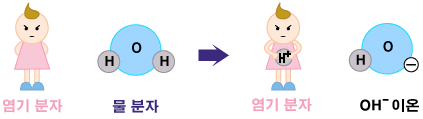
수산화 음이온을 가지고 있지 않은 염기는 물(H2O)로 부터 H+를 떼어옴으로써, 수산회 음이온을 만들어냅니다. 예로는 암모니아(NH3)가 있습니다.
우리 주위에서 흔히 보는 염기의 예로는 비누가 있습니다. 그리고 어머니들께서 빵 구우실 때 쓰시는 베이킹소다, 집 청소할 때 쓰는 세제에 들어 있는 암모니아, 등입니다. 그 외 공업적으로 쓰이는 염기로는 수산화나트륨, 수산화칼륨, 등이 있습니다.
▲ 우리 주변의 염기성 물질
물에 녹아 수산화 이온을 내놓거나 만드는 물질인 여러 염기도 수산화 음이온을 내어놓거나 만드는 능력이 각기 다릅니다. 수산화 음이온을 얼마나 많이 내어 놓는 가에 따라 강염기와 약염기로 다시 구분을 합니다. 깊이 알고 싶다면 아래 링크를 참조하세요.
|