|
▶ 기체를 액체에 녹이기 |
|
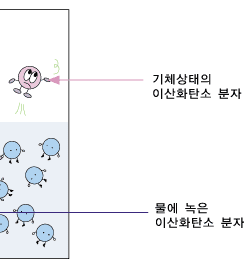
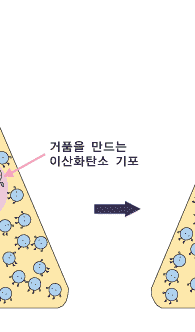
분자들이 뿔뿔이 흩어져 날아다니는 기체를 액체에 녹인다니까 이상하다구요? 전혀 이상하지 않습니다. 콜라, 사이다, 그 외의 탄산음료는 모두 물에 이산화탄소 기체를 녹여 놓은 것이랍니다. 그것들을 마실 때 코를 콕 찌르는 느낌이 바로 물에 녹아 있는 이산화탄소 때문입니다. 사이다 병을 흔들 때 나오는 기체를 모으는 동영상과 그 기체를 석회수에 통과시키는 동영상을 관찰해보세요.
이 관찰로부터 사이다에 이산화탄소가 녹아 있다는 것을 확인할 수 있습니다.
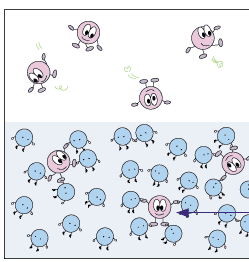
기체가 물에 녹은면 어떤 모습일까요? 기체가 물에 녹은 상태도 고체가 물에 녹은 상태나 녹은 후의 모습은 똑같습니다.
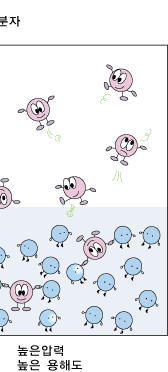
이산화탄소와 같은 기체가 물에 녹아 들어가는 정도 즉, 용해도는 온도, 그리고 용액과 인접하고 있는 기체 상에서의 기체의 압력에 따라 달라집니다. 좀더 간단한 온도에 대해 먼저 알아봅시다. 모든 기체는 물에 녹으면서 열을 내어 놓습니다. 따라서 온도가 높아지면 더 적은 양의 기체가 물에 녹을 수 있겠지요. 탄산음료 캔을 딸 때 온도가 높을수록 거품이 많이 나는 이유가 바로 이것 때문입니다.
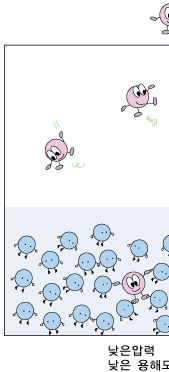
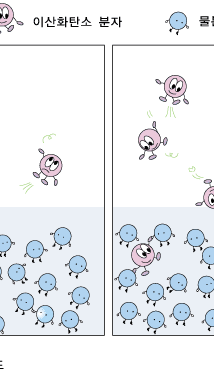
이제 기체 상의 기체의 압력에 따라 용해도가 어떻게 달라지는지 알아볼까요? 기체 상의 기체의 압력이 높아지는 것은 일정한 부피에 있는 기체 분자들이 더 많이 있는 것입니다. 기체들은 쉴 새 없이 여기저기 뛰어다니지요. 그러다가 물 표면에 부닥치기도 합니다. 물에 녹기 위해서는 물 표면에 접촉해야 하지요. 따라서 물 표면에 자주 부닥칠수록 물 분자들에게 잡혀 물 속에 녹아 들어갈 확률이 더 커집니다. 따라서 물과 이웃해 있는 기체 상에서의 기체의 압력이 높아질수록 기체의 용해도는 커진답니다.
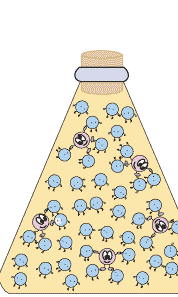
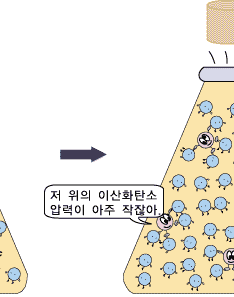
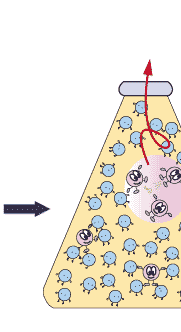
이때 중요한 것은 녹이려고 하는 기체의 압력입니다. 예를 들어, 이산화탄소에 의한 압력을 배로 하면, 용해도가 2배 커집니다. 하지만 질소를 넣어 기체 상의 전체 압력을 2배로 하여도, 이산화탄소의 용해도는 변하지 않습니다. 이산화탄소의 용해도는 낮은 이산화탄소 기압 하에서는 아주 작습니다. 따라서 적정량의 이산화탄소를 물에 녹여 탄산음료를 만들려면 이산화탄소의 압력이 아주 높아야 합니다.우리가 마시는 탄산 음료는 이렇게 높은 이산화탄소 압력 하에서 만듭니다. 이렇게 만들어진 탄산 음료 병을 따면 어떤 일이 일어날까요? 병의 뚜껑을 열면 탄산음료가 이산화탄소 압력이 아주 작은 대기와 접하게 되지요. 우리가 살아가는 대기 중의 이산화탄소의 압력이 너무 작아 그 조건에서 물에 녹아있을 수 있는 이산화탄소의 양이 아주 조금입니다. 그래서 녹아 있던 이산화탄소 분자들이 대부분 기체 상으로 빠져 나오려고 하지요. 이것이 바로 우리가 탄산음료를 따는 순간 볼 수 있는 거품입니다.
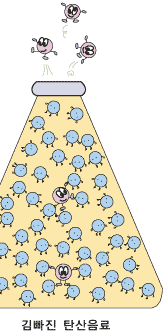
큰 병의 탄산음료를 조금씩 자주 마시다 보면 어느새 음료수의 톡 쏘는 맛이 사라지고 없지요. 왜 그런지 아래에서 알아보세요.
|